יש לנו מערכת חיסון מולדת ונרכשת שתפקידה לעמוד באתגרים חיסוניים המגיעים מהסביבה דרך הנשימה, הפה והעור.
יש לנו מערכת חיסון אחת ולא באמת משנה לה מה השם של המזהם. היא פשוט פועלת.
הרפואה בוחרת לתת לכל דבר שם ולדעתי היא גם הרבה פעמים מפספסת את העיקר וטועה במקור של המחלה, אבל לצורך ההבנה ויישור הקו, אני מציין גם את השמות של ה'וירוסים' והחיידקים במאמרים שאני משתף, שלדעתם מייצרים מחלות. ומה שחשוב הוא ההבנה שמה ש
אחד הגורמים העיקרים לתחלואה הוא הפגיעה באיזון של החיידקים הטובים הנמצאים במערכת העיכול. אם על ידי מזון מעובד, מרוסס, אם על ידי תרופות ואם על ידי מזהמים תעשייתיים.
הקשר בין המיקרוביום למערכת החיסון קיים ונחקר רבות. על פי רוב הקשר הוא ברמת האיתות למערכת החיסון, כלומר הם מייצרים מגוון של רכיבים וכשמערכת החיסון באה במגע איתם או עם מעטפת החיידק נוצרות תגובות חיסוניות.
מאמרים ששיתפתי בעבר שמראים את הקשר:
- ראינו את הקשר שלהם לדלקות כרוניות ולמחלות אוטואימוניות [1] לרבות לופוס , טרשת נפוצה, קרוהן וקוליטיס (חלבון P-glycoprotein), אסתמה ואטופיק דרמטיטיס/ פסוריאזיס.
- ראינו את חשיבותם בהקשר לזיהומים 'ויראליים' שונים לרבות קורונה [2]/שפעת, רוטה וחיידקים כמו כולרה. ראינו את הקשר שלהם במניעת זיהום חיידקי על ידי הפיכת ויטמין איי לפעיל (חומצה רטינואית).
- ראינו את השפעת חיידקי מעי המייצרים בוטיראט על אישפוזים עקב זיהום.
- ראינו את חשיבותם בכך שמונעים פגיעה במערכת העצבים ההיקפית עקב זיהום 'ויראלי'.
- ראינו את הקשר להיווצרות נוגדני IgA בהגנה מפני דלקות זיהומיות בקרום המוח.
- ראינו כיצד תיסוף של חיידקים טובים אצל קשישים העלה את רמות הפגוציטים ואת הפעילות האנטי סרטנית של תאי ההרג הטבעיים.
- ראינו את היכולות שלהם גם בקשר לסרטן מלנומה וריאות ובטיפול אימונולוגי וכן במניעה של גרורות. ראינו את חשיבותם במניעה של נזקי קרינת רדיו (טיפול ואבחנות לסרטן).
- ראינו את חשיבותם לשיקום מערכת החיסון עקב טיפולים מדכאי חיסון.
- מחקר שפורסם ביוני 20 בג'ורנל Gut מדגיש את התפקיד של TNF-tumour necrosis factor. החוקרים בדקו את הפנוטיפים של תאי pre-cDC1 ואת שיעור הפרשת הציטוקינים בטחול של יילודים שנולדו מאימהות שקיבלו אנטיביוטיקה.
החוקרים בחנו את תפקידם של TNF ( סוג של ציטוקין שמפעיל את מערכת החיסון), שמופרש מתאים מהשורה המיאלואידית (מונוציטים/ מאקרופגים וגרנולוציטים).
הם ביצעו ניתוח של רצפי ה-RNA מתאי pre-cDC1 ביילודים, שתפקידם העיקרי הוא ליצור תגובה חיסונית. ובמקביל הם בדקו את תפקוד התגובה החיסונית של תאי T מסוג CD8 כנגד ליסטריה (Listeria Monocytogenes).
תוצאות המחקר הדגימו כי חשיפה ראשונית של היילוד בסמוך לאחר הלידה למיקרוביוטה, עוררה הפרשה של TNF מתאים מונוציטיים ומאקרופאגים. החוקרים הראו כי הציטוקין הדלקתי, TNF, שמופרש מתאים מהשורה המיאלואידית הינה חשובה ביותר באתחול תהליך ההבשלה של תאים רגולטוריים מסוג pre-cDC1 ביילודים.
החוקרים גם הראו שבמהלך זיהום בחיידק הליסטריה, TNF המופרש מתאים מיאלואידים בעקבות חשיפה למיקרוביוטה מעודדים את תאי pre-cDC1 לאתחל תגובה חיסונית תאית של תאי T מסוג CD8 שלהם תכונות ציטוטוקסיות.
- *** תוספת נובמבר 20
במחקר, מבית היוצר של הארוורד, שפורסם בנובמבר 20 בג'ורנל Cell, החוקרים מראים לראשונה קשר נוסף שבין המיקרוביום להגנה מפני זיהומים 'ויראליים'. בעבודה הזו החוקרים מציגים סוג מסוים של חיידקים ממשפחת Bacteroides fragilis שמכילים במעטפת שלהם מולקולה שגורמת למערכת החיסון המולדת לייצר אינטרפרונים מסוג 1 (IFN-β) ולהם תכונות אנטיויראליות (גרימה לתאים הנגועים בנגיף להשמדה עצמית והמרצת סוגים אחרים של תאי חיסון לתקוף את הנגיף) דרך מנגנון שנקרא TLR4-TRIF signaling pathway.
כדי לקבוע אם B. fragilis יכול להגן מפני זיהום ויראלי, החוקרים בדקו שתי קבוצות עכברים, אחת שטופלה באנטיביוטיקה כדי לרוקן את חיידקי המעיים שלהם ואחת עם חיידקי המעיים השלמים. לאחר מכן, החוקרים חשפו את בעלי החיים לנגיף וסיקולר סטומטיטיס (VSV). בעלי החיים שטופלו באנטיביוטיקה היו בסיכון גבוה יותר לפתח זיהומים פעילים לאחר חשיפה לנגיף ולחוות תסמינים קשים יותר כאשר הם נדבקו.
לבסוף, כדי לוודא האם אותה מולקולה שנמצאת במעטפת החיידקים יכולה לווסת את אותה תגובה חיסונית, החוקרים נתנו אותה בצורתה הטהורה, לקבוצה שקיבלה אנטיביוטיקה בדרך מי השתייה שלהם. וכמה ימים לאחר מכן כשנחשפו לאותו וירוס הם סבלו מזיהומים קלים יותר באופן משמעותי עם הישרדות זהה לעכברים עם מיקרוביום תקין.
המסקנה של המחקר מבהירה שוב את החשיבות של המיקרוביום למערכת החיסון ואת הפגיעה בה כתוצאה משימוש באנטיביוטיקה, שכן הקבוצה שסבלה היא זו שקיבלה אנטיביוטיקה!

אנטיביוטיקה מעלה סיכון לחלות בשפעת.
- *** תוספת יולי 21
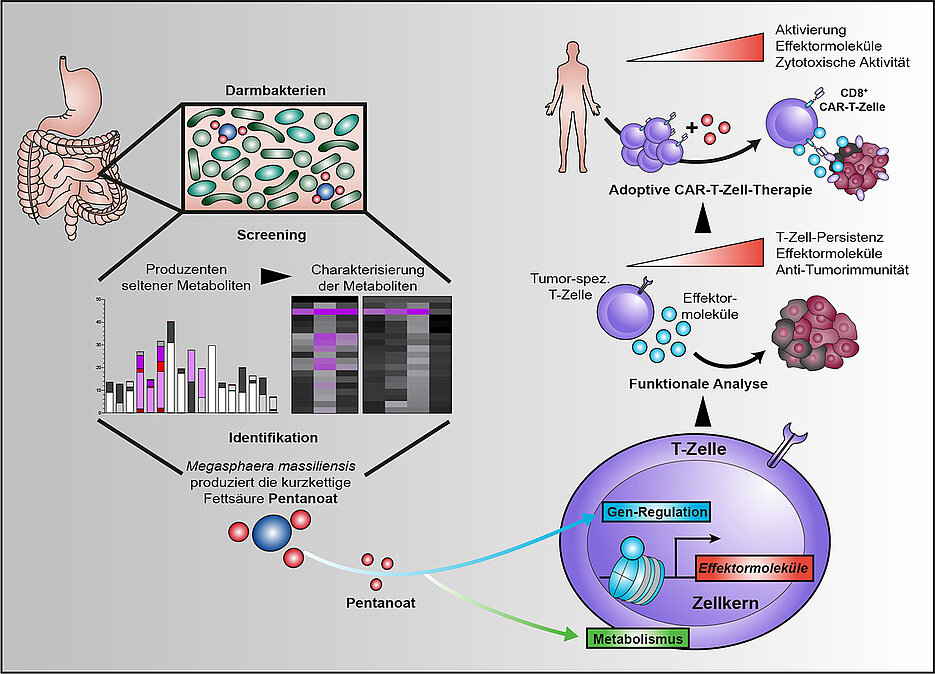
במחקר שפורסם ביולי 21 בג'ורנל Nature Communications מדענים באוניברסיטאות וירצבורג ומרבורג הצליחו בפעם הראשונה להוכיח בניסוי כי מטבוליטים חיידקיים (חומצות שומן קצרות בוטיראט ובמיוחד פנטנואט) מסוגלים להגביר את הפעילות הציטוטוקסית של תאי T מסוימים (CD8), שנקראים גם תאי הרג טבעיים (NK), שמטרתם להרוג ספציפית תאים המזיקים לאורגניזם. ובכך משפיעים באופן חיובי על יעילות הטיפולים כנגד גידולים.
חומצות שומן קצרות שרשרת (SCFAs), שייכות לסוג המטבוליטים הדומיננטי ביותר של מיקרוביום המעיים. מצד אחד, הם יכולים להגביר את חילוף החומרים של תאי T ומצד שני, הם יכולים לעכב אנזימים ספציפיים המווסתים את הנגישות לחומר הגנטי ובכך את הביטוי הגנטי בתאי T. בכך הם גורמים לשינויים אפיגנטיים.
החוקרים ראו שחומצות שומן אלה מתכנתות מחדש תאי CD8 T, אחת התוצאות היא ייצור מוגבר של מולקולות פרו-דלקתיות וציטוטוקסיות. הטיפול בחומצת השומן פנטנואט הגדיל את יכולתם של תאי T ספציפיים לגידול להילחם במודלים של גידולים מוצקים. ובפרט תאי T מסוג CAR-T, שספציפיים נגד גידולים ומהווים ב-20 שנים אחרונות כמוקד מחקרי לאימונותרפיה.
בעוד שתאי T "עיוורים" לתאי סרטן. תאי CAR-T מסוגלים לזהות אנטיגני יעד ספציפיים על פני הגידול ולהשמיד את תאי הסרטן הודות לשינוי האפיגנטי.
https://www.uni-wuerzburg.de/en/news-and-events/news/detail/news/anti-tumormittel-aus-dem-darm/
הטיפולים האימונותרפיים הם אמנם עדיפים על הכימותרפיה, כי הם למעשה מחקים את הפעילות הטבעית, אבל גם בהם יש תופעות לוואי במיוחד אוטואימוניות או תגובות יתר של החיסון.
המטרה שלנו בסופו של דבר היא לתת לגוף את מה שהוא צריך עוד לפני הגידול המסיבי. אנחנו צריכים לשמור על המיקרוביום שלנו מכל פגע.
- *** תוספת אפריל 22
חוקרים מאוניברסיטאות שטוקהולם, אומאו וגטבורג שבשבדיה מדווחים כיצד המיקרוביוטה של המעי חיונית לעמידות טבעית לזיהומים ויראליים: הרפס סימפלקס מסוג 1 (HSV-1), או וירוס סטומטיטיס (VSV). הם מראים ששחרור שלפוחית מהממברנה של חיידקי המעי (MVs) מוביל למסירה מערכתית של DNA חיידקי דרך קולטנים לתאי המארח. זה מפעיל את ציר cGAS-STING-IFN-I הציטוזולי עבור חישת DNA חיסונית מולדת, ובכך מגן על איברים מרוחקים מפני זיהומים ויראליים.
המחקר פורסם באפריל 22 בכתב העת Immunity.
החוקרים בחרו לבחון את תפקיד MVs מהסיבה שהן שלפוחיות דו-שכבתיות שומניות קטנות המשתחררות מחיידקים שכנראה יכולות לחצות רקמות כמו גם מחסומי קרום התא כמו כלי רכב המאפשרים לחיידקי מעיים להעביר DNA לתאי מארח מרוחקים. ואכן, בניסוי במבחנה ובעכברים הם מצאו ששלפוחיות אלה קידמו את פינוי הנגיפים. הם גילו שאינדוקציה של IFN-Is על ידי המיקרוביוטה כרוכה בהפעלה מתמדתשל מסלול cGAS-STING ושזה לא מצריך מגע ישיר בין חיידק לתא המארח.
החוקרים מוספים שהחיידקים הטובים הנמצאים במערכת העיכול חיוניים להתפתחות והבשלה של מערכת החיסון. הם גם מגנים מפני פתוגנים של על ידי התחרות שלהם על חומרים מזינים או אתרי התקשרות, ועל ידי ייצור חומרים אנטי-מיקרוביאליים.
https://www.su.se/english/news/the-gut-microbiota-protects-against-viral-infections-by-keeping-the-immune-system-alert-1.611782
- *** תוספת מרץ 23
חוקרים מבית הספר לרפואה של הרווארד פירסמו מחקר בפברואר 23 בכתב העת Immunity, שמוסיף לגוף גדל והולך של ראיות על חשיבות המיקרוביוטה של המעי בוויסות תפקודים פיזיולוגיים שונים מעבר למעי.
החוקרים מציינים שהתצפיות מצביעות על כך שחיידקי מעיים מניעים את הייצור של סוג של תאי T רגולטוריים, שיוצאים כל הזמן מהמעיים ומתפקדים כזקיפים שחשים נזק באתרים מרוחקים בגוף ולאחר מכן פועלים כשליחים לתיקון הנזק הזה. תאי T רגולטוריים אלה שוכנים באיברים שונים, שם הם שולטים בדלקת מקומית ומווסתים חסינות ספציפית לאיברים.
החוקרים מסבירים שהם כבר מכירים את תאי Tregs שנמצאים בדרך כלל במעי הגס. וממלאים תפקיד חשוב בשמירה על בריאות המעיים, כגון הגנה על הגוף מפני אלרגנים למזון, מצבים אוטואימוניים כמו קוליטיס, ואפילו סרטן המעי הגס. החוקרים ידעו גם שחיידקי מעיים פועלים כמווסתים של חסינות המעיים על ידי שליטה בייצור של Tregs, אך ראו עדויות נדירות לכך ש-Tregs של המעיים יכולים להשפיע על רקמות ותהליכים מעבר למעי.
לכן, כאשר במהלך קטלוג שגרתי של תאי חיסון שונים באיברים שונים הם נתקלו ב-Tregs המעיים המעורבים בתאי שריר, החוקרים היו תחילה מבולבלים, ויצאו לבחון זאת מקרוב.
כדי לאמת את התצפית יוצאת הדופן שלהם, החוקרים נאלצו תחילה לקבוע את הזהות האמיתית של ה-Tregs שמצאו ברקמת השריר. הם היו צריכים להראות שאלו באמת היו ה-Tregs של המעי הגס.
לשם כך, החוקרים נאלצו תחילה לקבוע את הזהות האמיתית של ה-Tregs שמצאו ברקמת השריר. הם היו צריכים להראות שאלו באמת היו ה-Tregs שמכירים מהמעי הגס. לשם כך, ניתחו המדענים את החתימות המולקולריות של התאים. הניתוח אישר שאכן מדובר בTregs דמויי המעי הגס. אחר כך הם סימנו את טרגס המעי הגס באור ועקבו אחריהם כשהם עשו את דרכם סביב גופם של העכברים. הצוות הבחין כי תאים אלה מתויגי אור עזבו את המעיים של העכברים והיגרו לחלקים אחרים של גופם של החיות. לבסוף, הם בחנו את הקולטנים לאנטיגנים של ה- Tregs , מעין ברקוד ייחודי המסמן כל תא ואכן תאי החיסון שמצאו בשריר חלקו את אותם ברקודים עם תאי Treg המקבילים במעיים.
לאחר מכן, החוקרים בדקו האם לתאים אלו יש תפקיד בהתחדשות השרירים.
בניסוי אחד, עכברים שעברו שינוי גנטי ללא סוג זה של Tregs המעי הגס הראו שיעורי התאוששות שרירים איטיים באופן ניכר. בהסתכלות מקרוב על תהליך הריפוי, החוקרים גילו שלעכברים אלו יש רמות גבוהות יותר של דלקת ברקמת שריר פצועה. וכאשר הם החלימו בסופו של דבר, העכברים פיתחו צלקות שרירים, או פיברוזיס, סימן לתיקון שרירים לקוי.
כדי לקבוע אם חיידקי מעיים הניעו את הייצור של Tregs המעי הגס לריפוי רקמת שריר, החוקרים האכילו עכברים אנטיביוטיקה כדי לרוקן את חיידקי המעי המועילים שלהם. לעכברים שטופלו באנטיביוטיקה היה קשה יותר להתאושש מפציעה בשריר. כאשר מיקרוביוטת המעיים שלהם שוחזרה, כך גם יכולתם של בעלי החיים לרפא את השרירים שלהם.
ניסויים נוספים הראו כי Tregs המעי הגס סייע לתהליך ריפוי השרירים על ידי דיכוי אות דלקתי הנקרא IL-17. הורדת רמות האות הזה במהלך חלון זמן מדויק מיתנה את התגובה הדלקתית ועזרה לעצור את הדלקת כאשר היא לא הייתה נחוצה עוד לתהליך הריפוי.
החוקרים מסבירים שכאשר השרירים מתרפאים, צריך מנה מסוימת של דלקת בתוך מסגרת זמן מסוימת. ובהיעדר תאי Tregs שמקורם במעיים, מצאנו שמידת הדלקת נעשית גבוהה יותר ומתארכת לאורך זמן רב יות, ובסופו של דבר יש לך תיקון נחות.
בשלב הבא, החוקרים רצו לראות אם תאי מערכת החיסון של המעי ממלאים תפקיד דומה לתיקון נזקים באופן כללי יותר.
כדי לענות על השאלה הזו, הם חיפשו עקבות של נוכחות של Treg במעיים באיברים שונים כולל הכבד, הכליות והטחול. כל האיברים הללו הכילו טרגים מעיים, אך ברמות נמוכות יותר מאשר בשרירים פצועים. כדי לקבוע אם טרגס מעיים יגדלו בתגובה לפגיעה באיברים אלה, החוקרים גרמו למחלת כבד שומני בקבוצת עכברים. מחלה שידועה גם בצלקות של הכבד.
הניסויים של החוקרים הראו שלעכברים עם כבד שומני היו רמות גבוהות יותר של Tregs במעי הגס מאשר לעכברים עם כבד בריא – תצפית שאישרה את תפקידם של Tregs המעי בשליטה בדלקת מחוץ למעיים.
יתרה מכך, לעכברים עם כבד שומני שהיו גם מהונדסים גנטית כך שהם חסרים Tregs המעיים, היו תוצאות גרועות יותר מהמחלה שלהם, והראו צלקות כבד גרועות יותר. ממצא זה אישר את התפקיד המגן של תאי Treg במעיים בהפחתת דלקת וצלקות במחלת כבד שומני.
המחקר מבהיר משחקי גומלין חשובים בין חיידקי המעי למערכת החיסון, ומדגיש את התפקיד הרב-תכליתי שחיידקי המעי יכולים למלא בהשפעה על תפקוד מערכת החיסון מחוץ למעי.
אבל מעבר לכך, התוצאות מדגישות את החשיבות של שמירה על מיקרוביוטת מעיים בריאה. שאלה מעניינת אחת שהמחקר מעלה היא התזמון של טיפול אנטיביוטי באנשים עם פציעות שרירים ושלד, לאור הפוטנציאל של התרופות לעכב את תגובת הריפוי על ידי שיבוש המיקרוביוטה של המעיים.
באופן רחב יותר, הוסיפו המחברים, הממצאים מעלים את האפשרות שתאי מערכת החיסון של המעי עשויים להיות מעורבים בריפוי נזקים באיברים שונים אחרים בגוף – שאלה שהם מתכננים לחקור במחקריהם הבאים.

במאמר: "תשמרו על הכבד שלכם" מוצג גם הקשר בין חיידקי המעי לתיקון נזקי כבד והתחדשותו.
ראו גם: "מיקרוביום בריא חשוב לבנית מסת שריר".
איך שומרים על מיקרוביום מגוון ובריא?
תזונה מגוונת מבוססת צומח[1] (כל הצבעים, כל הטעמים, כל המרקמים), כל המשפחות (פירות וירקות עם קליפה, דגנים מלאים, קטניות, אגוזים, שקדים, זרעים ונבטים ומונבטים) וגם בתוך המשפחות לגוון לדוגמה: ירוקים זה לא רק חסה ופטרוזיליה. זה גם מנגולד, רוקט, רוקולה, תרד, סלרי, בזיליקום, נענע ועוד ועוד. עדשים זה גם ירוק, צהוב, כתום, חום, שחור, קטניות יש עשרות סוגים. כאשר יש סייג אחד. מה שלא עושה טוב. מורידים!
דרכים נוספות לקבל לחיזוק החיידקים הטובים: סיבים תזונתיים, עמילנים עמידים ומזון מותסס: כרוב כבוש (sauerkraut)[1], קימצ'י (קוראני), טמפה (אינדונזי), נאטו ומיסו (יפני), משקה קומבוצ'ה. וכמובן התססת פירות וירקות ביתית. והמדריך הבא לדעתי הוא השלם ביותר חלק 1, חלק 2. ישנה גם הדרכה דרך סרטונים אחרי הרשמה כאן.
במקביל להמנע ממגע וצריכה של:
תרופות המשנות לרעה את הרכב המיקרוביום במיוחד אנטיביוטיקה, אבל גם נוגדות חומציות (PPI), מטפורמין, לקסטיבים, תרופות נוגדות דיכאון (SSRI), סטרואידים ונוגדי דלקת שאינם סטרואידים.
חומרי חיטוי (אנטיבקטריאליים) המכילים למשל טריקלוזן.
תכשירים המכילים משבשי אותות אנדוקריניים כגון פתלאטים ו'חומרים אורגניים מופלרים, PFAS, BPA, מעכבי בעירה, מזונות מרוססים[2][3] ואולי במיוחד גלייפוסט. וגם פלסטיק.
מזון מעובד[2][3][4][5]/ ומזון מסוכר.
היי לך.. אני משקיע שעות רבות כל יום באיתור ותרגום מאמרים כדי לספק לכולם את המידע העדכני ביותר, לבריאות טובה בדרך הטבע. וכדי שאוכל להמשיך לספק את המידע ולתחזק את האתר. כל תרומה, גדולה או קטנה תהיה לעזר רב. לתרומה נוחה ופשוטה דרך Pay Pal.
מוזמנים להזין דוא"ל למטה כדי להתעדכן ראשונים





כתיבת תגובה