שלבי התפתחות המוח
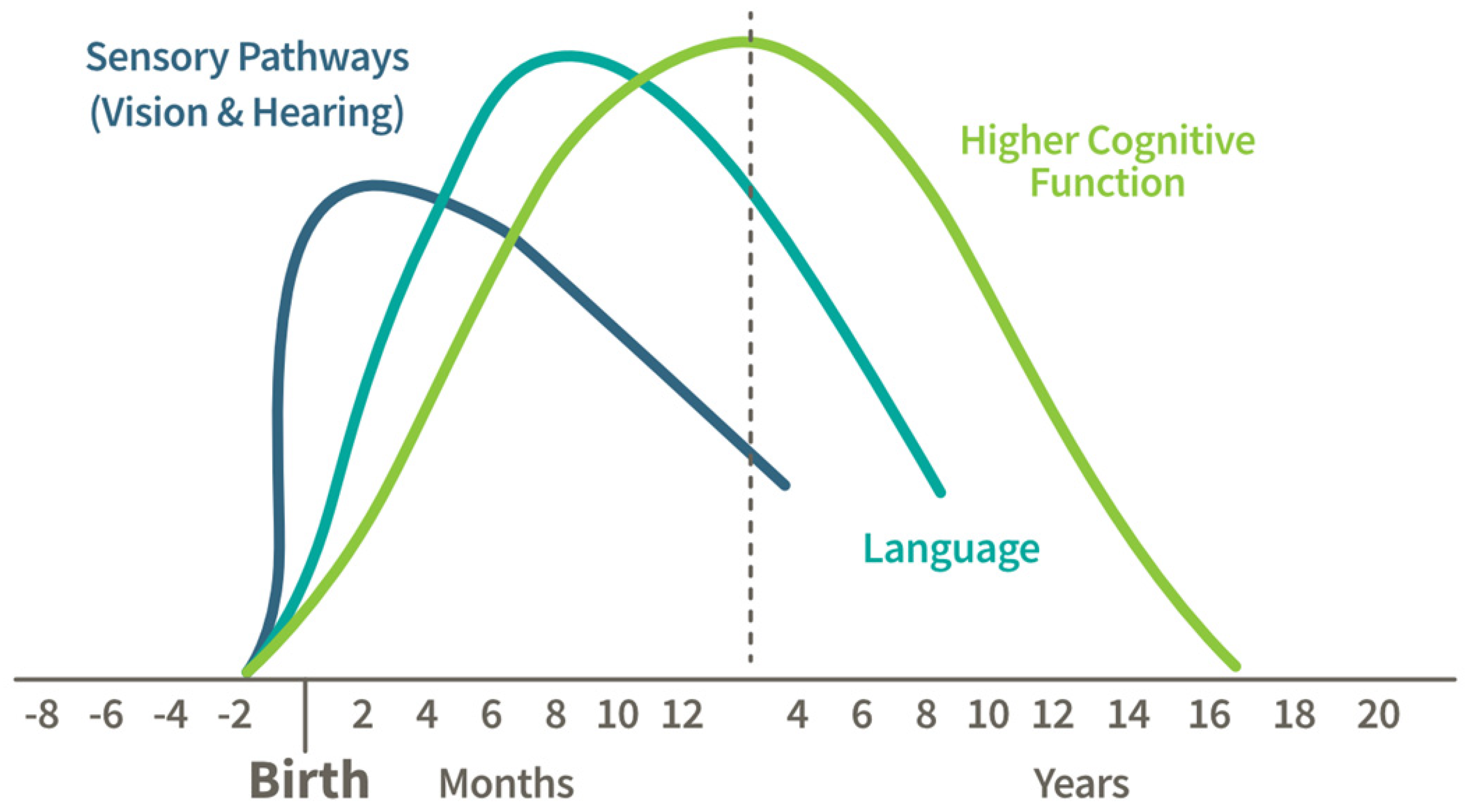
התפתחות המוח מתחילה בשלבים המוקדמים של התפתחות העובר, עם היווצרות הצינור העצבי בשבועות הראשונים לאחר ההתעברות, מה שיוצר את המוח וחוט השדרה.
בשליש השני, נוירונים מתחילים להתרבות במהירות ויוצרים את אבני הבניין של מבנה המוח.
במהלך השליש השלישי והתקופה המוקדמת שלאחר הלידה, יצירת קשרים בין נוירונים (סינפטוגנזה) מואצת, ומניחה את היסודות ליכולות חושיות, מוטוריות וקוגניטיביות.
הילדות המוקדמת מאופיינת בעלייה חדה בקשרים סינפטיים, המכונה ייצור יתר סינפטי, התומך בלמידה ובהסתגלות לסביבה. לאחר מכן מתרחש גיזום סינפטי, לפיו קשרים שאינם בשימוש מסולקים כדי לשפר את היעילות העצבית.
גיל ההתבגרות הוא תקופה קריטית להתפתחות קליפת המוח הקדם-מצחית, האחראית על קבלת החלטות, שליטה בדחפים וחשיבה מורכבת. מיאלינציה, תהליך בידוד מסלולים עצביים לשיפור העברת אותות, נמשכת גם בבגרות המוקדמת, ומאפשרת תקשורת מהירה ויעילה יותר בין אזורי המוח. יחד, תהליכים אלה מעצבים את מבנה ותפקוד המוח, ותומכים בלמידה ובהסתגלות לכל החיים.
המוח הוא פלסטי במיוחד ועמיד בפני נזק. לכן, ירידה קוגניטיבית לוקחת זמן רב ותסמינים בדרך כלל מתבטאים מאוחר יותר בחיים בהשוואה למצבים כרוניים אחרים. למעשה, ירידות קוגניטיביות מתחילות בדרך כלל ברמה הפיזיולוגית החל משנות ה-30, אך תסמיני הירידה הקוגניטיבית אינם ניתנים למדידה בדרך כלל עד שנות ה-40 וה-50. תסמינים של ירידה קוגניטיבית המשפיעים על איכות החיים מתבטאים בגילאים מאוחרים יותר בחיים.
לכן, אנשים צריכים להתחיל לדאוג להגנה ולשימור של תפקוד המוח לאורך כל החיים.
מכיוון שאותם מנגנונים התורמים לירידה קוגניטיבית הקשורה לגיל (הזדקנות תקינה) חופפים לאלו התורמים למחלות ניווניות של מערכת העצבים, התערבויות המעניקות יתרונות נוירו-פרוטקטיביים לאנשים בריאים רלוונטיות לעתים קרובות גם למצבי מחלה.
טיפוח, הגנה ותמיכה בבריאות מוח אופטימלית דורשים התחשבות במגוון רחב של גורמים הכוללים: דלקת ועקה חמצונית. מיקרו-נוטריינטים (ויטמינים ומינרלים) כמו גם פיטוכימיקלים.
מסלולים ומנגנונים הקשורים למוח, שלעתים קרובות ממוקדים על ידי פיטוכימיקלים, ויטמינים ומינרלים, כוללים: פעילות מערכת העצבים המרכזית (CNS), קוגניציה, מצב רוח, שינה, לחץ וקצב צירקדי.
ההיסטוריה המחקרית של משפחת המצליבים
בשנות ה-70, צריכת ירקות מצליבים נקשרה לירידה בשכיחות של מגוון סוגי סרטן. במהלך השנים, קשרים אלה התרחבו וכללו מגוון מצבים, כולל כאלה המשפיעים על בריאות המוח. ב-6 השנים האחרונות נערכו מחקרים אפידמיולוגיים שהראו שלצריכה גבוהה יותר של ירקות מצליבים, סיכוי נמוך משמעותית לחוות סטרס גבוה ולהדרדרות קוגניטיבית בגיל מאוחר יותר. השפעות אלו נובעות ככל הנראה מנוכחותם של איזותיוציאנטים (ITC) ובמיוחד סולפוראפן (SF), שהפך לימים אחד הפיטוכימיקלים הנתמכים בצורה הקפדנית ביותר על ידי מחקרים מדעיים – ניסויים קליניים במעבדה, בבעלי חיים ובבני אדם.
תהליך ההמרה של סולפוראפן
סולפוראפן ואיזותיוציאנטים מירקות מצליבים קיימים בצמחים שלא נפגעו. הגלוקוזינולט הראשוני נקרא גלוקוראפנין (GR). והוא אינו פעיל ביולוגית בצורתו הטבעית, אלא מומר לסולפוראפן על ידי האנזים מירוזינאז, שמופעל על ידי קריעת הצמחר, לעיסה, תהליך הקפאה-הפשרה, חיתוך וקציצה.
חשוב לציין שאנזים זה מיוצר גם על ידי תת-קבוצה של חיידקי מעי שנמצאו בכל האנשים שנחקרו עד כה.

סקירה ספרותית של היכולות המגנות של סולפוראפן
מחקר שפורסם באפריל 25 בכתב העת Nutrients מספק מידע ממסלולי פעולה ועד להשפעות על הפרעות ספציפיות הקשורות למערכת העצבים והמוח. המחקר מציג מספר מסלולים מכניסטיים רלוונטיים מבחינה נוירולוגית שבהם ל-SF יש פוטנציאל להעניק השפעות נוירו-פרוטקטיביות ואנטי-נוירוטוקסיות הן במוח האנושי והן במערכת העצבים המרכזית, לאורך שלבי החיים.
- שימור שלמות ותפקוד מחסום הדם-מוח (BBB).
מחסום הדם-מוח הוא מנגנון המגן על המוח מפני רעלים תאיים וסביבתיים ותרכובות מזיקות אחרות. הוא נוצר על ידי שיתוף פעולה של תאי אנדותל, עצב ותאי שריר חלק היוצרים את דפנות הנימים המספקים דם למוח. על פני ממשק זה, יש: (א) מחסום פיזי שנוצר על ידי צמתים הדוקים בין תאים; (ב) מחסום להובלה, כתוצאה מתעלות יונים ואמצעים אחרים לוויסות שטף מומסים, ו-(ג) מחסום מטבולי שנוצר על ידי קבוצה של אנזימים.
מחסום הדם-מוח מווסת הן מבחינה פיזיולוגית והן מבחינה פתולוגית במגוון דרכים מכיוון שהוא מורכב מתאי אפיתל, תאי עצב ותאי שריר חלק.
_______ ______
______
המחסום שולט בזרם של מולקולות קטנות, מטבוליטים ואפילו תאים חיסוניים; הוא קריטי לפינוי פסולת מטבולית ותוצרים אחרים של פעילות מוחית; מייצר סביבה יציבה ושומר על ההומאוסטזיס הנדרש לתפקוד עצבי מורכב; שחרור אותות ויונים אשר בתורם מווסתים את זרימת הדם.
ל-SF יכולת לחצות את ה-BBB ולהצטבר ברקמות מערכת העצבים המרכזית. זה גם אחד ממנגנוני הפעולה המרכזיים שבאמצעותם SF מפעיל את השפעותיו הנוירו-פרוטקטיביות. - SF מעלה את מנגנוני נוגדי החמצון וניקוי הרעלים.
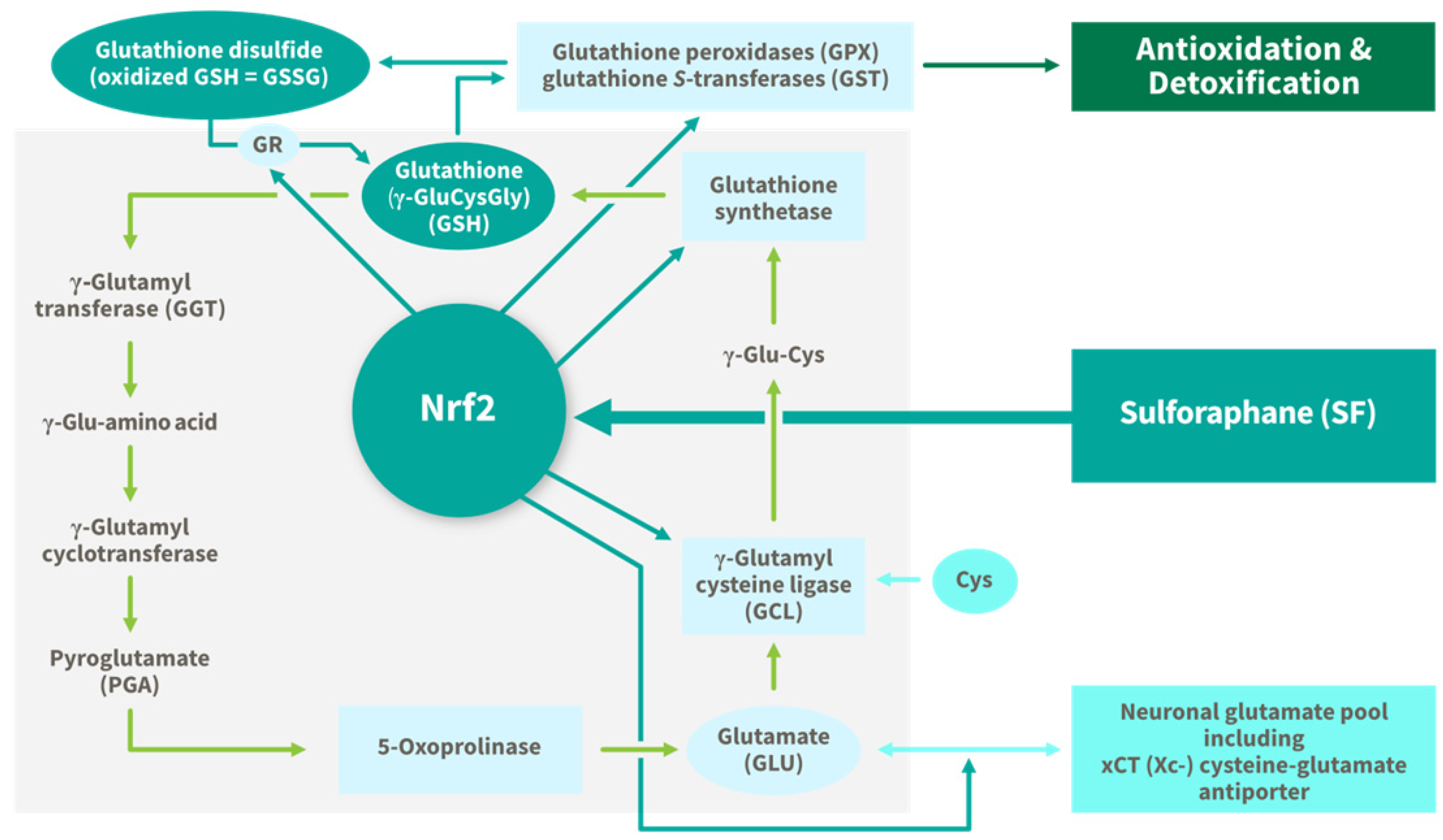
עקה חמצונית היא גורם מבוסס הקשור לנזק למערכת העצבים המרכזית. כמו כן ידוע כי המוח זקוק לכ-20% מצריכת החמצן של הגוף כולו למרות שמהווה כ-2% ממסת הגוף. כמו כן מה שהופך את המוח לרגיש במיוחד לנזק חמצוני, הוא תכולת השומנים הגבוהה במוח, במיוחד חומצות שומן רב בלתי רוויות, שנוטות להתחמצן ביתר קלות. לכן, שמירה על סטטוס נוגדי חמצון ואיזון חמצון-חיזור במוח היא מרכיב מפתח בהגנה עצבית. למרבה המזל, קיימים מספר מנגנוני הגנה כדי להגן על המוח מפני פגיעה מזיקה זו. אחד המסלולים המובנים והנחקרים ביותר הוא מסלול Keap1/Nrf2. המופעל על ידי SF, המווסת את הביטוי של בין 250-500 גנים, המהווים 3-5% מכלל שעתוק החלבונים התאיים. גנים אלה מקודדים לגורמים ציטופרוטקטיביים כנגד רדיקלים אלקטרופיליים, רעלים, חומרים מסרטנים כימיים וגורמי עקה ישירים. בין 500 הגנים ש-SF יכול להגביר את רמת הוויסות שלהם נמצאים אנזימים נוגדי החמצון וניקוי רעלים: NAD, (NQO1) ,(HO-1 ), (Cat), (SOD), (Prx), (HSP), גלוטתיון S-טרנספראז (GST), (Trx), גלוטתיון סינתטאז (GS), גלוטתיון פרוקסידאז (GPx) וגלוטתיון רדוקטאז.- גלוטתיון (GSH) הוא אחד מנוגדי החמצון האנדוגניים החשובים ביותר במוח, והוא נוגד החמצון הלא-אנזימטי הפנימי הנפוץ ביותר בגוף האדם. הוא ממלא תפקיד מפתח בוויסות ובתחזוקה של מצב החמצון-חיזור התוך-תאי במוח, וכן משתתף במספר פונקציות ניקוי רעלים. גירעונות בריכוזי GSH במוח קשורים לעלייה בנזק חמצוני, יכולת לקויה לרכך ולייצא רעלים, עליה של דלקת עצבית, וחוסר וויסות חנקן חמצני (NO) וכתוצאה מכך מוות של תאים עצביים. לכן יכולתו של SF להגביר את רמות GSH במוח היא קריטית להגנה נוגדת חמצון בגיל צעיר, אך עשויה להפוך לחשובה אף יותר עם הגיל. הסיבה לכך היא שריכוזי GSH במוח מדולדלים גם בהזדקנות תקינה. SF הוכח באופן עקבי כמגביר את הסינתזה של GSH ברקמות מגוונות, כולל במוח ובמערכת העצבים המרכזית על ידי הגברת האנזימים המעורבים בסינתזה, מיחזור ופינוי כל האנזימים הקשורים לייצור גלוטתיון כמו גם שמירה על מאזן החמצון-חיזור של גלוטתיון.
_____ ______
______ - ניקוטינאמיד אדנין דינוקלאוטיד (NAD+)
בעל פעילות נוגדת חמצון תאית קריטית, הגורמת ישירות לסילוק רדיקלים של סופראוקסיד, וכן מפעילה השפעות נוגדות חמצון עקיפות על ידי חידוש נוגדי החמצון GSH, קואנזים Q10 ואלפא-טוקופרול (ויטמין אי), שכולם ממלאים תפקידים קריטיים בהגנה עצבית, ותורמים יחד לשמירה על מאזן החמצון-חיזור של המוח ומערכת העצבים המרכזית. בנוסף הוא מעורב בזיהוי, תיקון והסרה של חלבונים פגומים, ממלא תפקיד מגן מפני הגנוטוקסיות של בנזן והמטבוליטים שלו.
SF מגביר את ביטוי הגן המייצר NAD ברוב הרקמות שנבדקו, כולל בתוך מערכת העצבים המרכזית. - אנזים Heme Oxygenase (HO-1; HMOX; HSP32)
HO-1 הוא אנזים בעל השפעות נוירו-פרוטקטיביות מבוססות היטב, אשר נקשרו לתופעת נוגדי החמצון ופיזור הרעלים. מתועד היטב כמנגנון מכריע לתגובת עקה במערכת העצבים, שם רמותיו המכוננות נמוכות למדי, אך ניתן להשריה גבוהה. האנזים מגן על תאים באמצעות פונקציונליות נוגדת החמצון שלו, ומכוון ספציפית לרדיקל סופר-אוקסיד ולמיני חמצן תגובתיים אחרים. בנוסף, הוא מווסת תגובות דלקתיות, ומספק הגנות אנדוגניות חשובות מפני פגיעה חמצונית ודלקתית במוח.
SF (5 מ"ג/ק"ג) מגביר את ההגנות נוגדות החמצון, ות הביטוי של HO-1 במוח ומונע ירידה קוגניטיבית הקשורה לגיל על ידי שמירה על תפקוד המיטוכונדריה ועלייה משמעותית במגוון גנים המווסתים על ידי Nrf2, כולל אלו שיוצרים HO-1.
החוקרים מסבירים שניקוי רעלים הוא תהליך, שכרוך בהסרה או ניטרול של רעלים (קסנוביוטיקה) מהסביבה, ממזון או מתרכובות המיוצרות באופן אנדוגני. מטבוליזם קסנוביוטי כולל שלושה שלבים המתווכים באמצעות אנזימים ממשפחת הציטוכרום P450, שמכניסים קבוצות ריאקטיביות לקסנוביוטיקה; בשלב השני, קסנוביוטיקה מצומדות לתרכובות פולריות, ובמיוחד לגלוטתיון (GSH) ובשלב השלישי הסרה מהתאים על ידי נשאי שפיכה, ולאחר מכן הפרשה מהגוף בזיעה, צואה, נשימה או שתן.
SF הוא אחד המקדמים החזקים ביותר של ניקוי רעלים דרך השלב השני.
המחברים מציינים למשל שזיהום סביבתי נקשר לתוצאות בריאותיות שליליות רבות, כולל תוחלת חיים קוצרה ועלייה במחלות כרוניות, אך בעיקר כולל גם מגוון בעיות נוירו-התפתחותיות, רעילות עצבית וסיכון מוגבר לדמנציה. כמו כן קיימים מאות מאמרים העוסקים ביכולת ניקוי הרעלים של SF, וישנם למעלה מאלף מחקרים בתחום ניקוי רעלים. הם בחרו להתמקד במגוון מחקרים קליניים שחלק מהמחברים (של המחקר הנוכחי) היו מעורבים בהם, המדגימים את רוחב הטווח של יכולות ניקוי הרעלים של נבטי ברוקולי. למשל ניקוי הרעלים של אפלטוקסין (המיוצר על ידי עובשים), חומר מסרטן ורעלן חזק בכבד, שחוצה את מחסום המוח (BBB) ומוביל למגוון הפרעות נוירו-התפתחותיות ונוירולוגיות בנוסף להשפעותיו על עיכוב בגדילה ועל יכולתו המסרטנת החזקה. נבטי ברוקולי ניצפו מצמדים לאפלטוקסין וומסייעים להפרשה משופרת שלהם מהגוף. כמו כן נמצא קשר הפוך משמעותי ביותר בין רמות השתן של אפלטוקסינים מסויימים לבין רמות סמן ביולוגי (דיתיוקרבמט) של SF. ממצא שמצביע על כך ש-SF מפעיל פעולה שמסיטה את תוצר הביניים הריאקטיבי הרחק מה-DNA ולכיוון GSH, מה שמאפשר את הפרשתו בשתן.
מספר ניסויים קליניים בקנה מידה גדול דיווחו כי תוספת של SF הגבירה את הפרשת מזהמי האוויר הסביבתיים (בנזן ואקרוליין) בשתן.
SF נמצא תורם לסילוק מזהמי אוויר אחרים כמו עשן (סיגריות ובעירה לרבות דיזל) שניקשרו לדמנציה ופרקינסון.
בנוסף SF עשוי גם למנוע או להאט את תהליך ההזדקנות התקינה של המוח ובעיות זיכרון מחומרי הדברה כמו רוטנון, המקושרים לסיכון מוגבר למחלת פרקינסון. נראה שהוא גם מקל על השפעות קוטלי פטריות, הגורמים לשינויים תעתוקיים דומים לאלה שנצפו בדגימות מוח של אנשים עם אוטיזם, אלצהיימר ומחלת הנטינגטון.
- גלוטתיון (GSH) הוא אחד מנוגדי החמצון האנדוגניים החשובים ביותר במוח, והוא נוגד החמצון הלא-אנזימטי הפנימי הנפוץ ביותר בגוף האדם. הוא ממלא תפקיד מפתח בוויסות ובתחזוקה של מצב החמצון-חיזור התוך-תאי במוח, וכן משתתף במספר פונקציות ניקוי רעלים. גירעונות בריכוזי GSH במוח קשורים לעלייה בנזק חמצוני, יכולת לקויה לרכך ולייצא רעלים, עליה של דלקת עצבית, וחוסר וויסות חנקן חמצני (NO) וכתוצאה מכך מוות של תאים עצביים. לכן יכולתו של SF להגביר את רמות GSH במוח היא קריטית להגנה נוגדת חמצון בגיל צעיר, אך עשויה להפוך לחשובה אף יותר עם הגיל. הסיבה לכך היא שריכוזי GSH במוח מדולדלים גם בהזדקנות תקינה. SF הוכח באופן עקבי כמגביר את הסינתזה של GSH ברקמות מגוונות, כולל במוח ובמערכת העצבים המרכזית על ידי הגברת האנזימים המעורבים בסינתזה, מיחזור ופינוי כל האנזימים הקשורים לייצור גלוטתיון כמו גם שמירה על מאזן החמצון-חיזור של גלוטתיון.
- הגנה אקטיבית על תפקוד המיטוכונדריה וחילוף החומרים של תאי עצב והגנה מפני נזק מיטוכונדריאלי.
החוקרים מסבירים שגירעונות הקשורים לגיל של גלוטתיון (GSH) במוח, כולל גירעונות בשברים מיטוכונדריאליים במוח ולפגיעה בתפקוד המיטוכונדריה וייצור אנרגיה. תפקוד לקוי ונזק מיטוכונדריאלי מעורבים בירידה הקוגניטיבית הקשורה להזדקנות תקינה, כמו גם בפתוגנזה של רוב ההפרעות הנוירודגנרטיביות. כל הראיות מצביעות על כך שמסלול גורם השיעתוק Nrf2 מעורב באופן הדוק במספר היבטים של תפקוד המיטוכונדריה וחילוף החומרים, וממלא תפקיד מרכזי בשמירה על בריאות המיטוכונדריה וחילוף החומרים התאי, במיוחד בהקשר של מחלות נוירודגנרטיביות כמו פרקינסון ואלצהיימר. הוא גם מווסת אנזימים המעורבים בחילוף החומרים של גלוקוז ושומן.
SF הוא מפעיל Nrf2 חזק, בכך משפר את תפקוד המיטוכונדריה. הוא מונע חדירות מיטוכונדריאלית ומגן מפני תפקוד לקוי של המיטוכונדריה הנגרמת על ידי תוצרי לוואי של חמצון שומנים.
SF מגרה ביוגנזה מיטוכונדריאלית, שומר על פעילות קומפלקס נשימתי ומשפר פרמטרים ביו-אנרגטיים, כולל צריכת חמצן.
החוקרים מוסיפים שהגנה מיטוכונדריאלית דרך מסלול Nrf2 תומכת גם בחוסן כנגד מגוון רחב של נוירוטוקסינים, אשר יכולים לשבש את ייצור ATP. היקף נוירו-פרוטקטיבי רחב זה של SF כולל נזק מופחת במודלים של מחלת הנטינגטון, אפילפסיה ונוירופתיה הנגרמת על ידי כימותרפיה, כמו גם חשיפה לפחמן חד-חמצני ורעלים סביבתיים שונים אחרים.
בכך SF מגן על נוירונים מפני עקה חמצונית, רעילות ואפופטוזיס, וממצב אותו כגורם רב-תכליתי כנגד השפעות של נוירוטוקסינים סביבתיים ותרופתיים. כמפעיל Nrf2 חזק, SF מטפל הן בעקה חמצונית ודלקת מערכתית והן ספציפית למוח, כמו גם משפר את הביו-אנרגטיקה והחוסן המטבולי המיטוכונדריאלי. - אפנון והגנה מפני דלקת עצבית.
ידוע כי דלקת כרונית ממלאת תפקיד מרכזי בהזדקנות ובמחלות הקשורות לגיל, כולל סוכרת, מחלות לב וכלי דם, הפרעות אוטואימוניות וכו'. באופן דומה, דלקת עצבית היא גורם סיכון נפוץ למצבים קוגניטיביים, כולל ירידה קוגניטיבית הקשורה לגיל, דמנציה, שבץ מוחי ומחלת אלצהיימר. למעשה, דלקת עצבית נחשבת כיום לגורם סיכון מועד לפגיעה בלמידה ובזיכרון. דלקת עצבית מוגברת ועקה חמצונית, המונעים על ידי הפעלה מוגברת של תאי מיקרוגליה, קשורים לירידה קוגניטיבית הקשורה לגיל.
מספר מחקרים תיעדו את ההשפעות המווסתות דלקת של SF, ובמיוחד את יכולתו לחסום את המסלול הפרו דלקתי NF-kB. המחקרים הראו כי SF יכול להפחית את רמות הציטוקינים הפרו-דלקתיים IL-6, IL-1β, TNF-α, ואת פרוסטגלנדין (PGE2), כמו גם את הביטוי של האנזים הפרו-דלקתי (COX-2). בנוסף, SF מנטרל את הציטוקין הפרו-דלקתי (MIF) ואת ייצור תחמוצת החנקן.
תכונותיו החזקות של SF לוויסות דלקת מצביעות גם על יתרונות פוטנציאליים לוויסות מצב הרוח ולמניעת דיכאון. קשר זה נתמך על ידי ראיות לכך שדלקת עצבית לא מווסתת תורמת להתפתחות דיכאון ותסמיני דיכאון, כאשר ההשפעות מתבטאות כבר בגיל ההתבגרות. - ציר המעי מוח – התקשורת הדו-כיוונית בין המעי למוח.
תחום מחקר פעיל מאוד, והוא פועל יוצא של הצמיחה הגוברת בידע על המיקרוביום של המעי שהתרחשה מאז שנת 2005 בערך. כיום קיימים מחקרים משכנעים המצביעים על כך של-SF יכול להשפיע על תפקוד המוח באמצעות מנגנונים הקשורים למעי.
SF מווסת את הרכב המיקרוביום, הוא מפחית דלקת ומשפר את שלמות מחסום המעי, והוא עשוי לווסת ישירות את האיתות בין המעי למוח דרך עצב הואגוס, ייצור חומצות שומן קצרות שרשרת כמו בוטיראט, בעלות השפעות נוירו-פרוטקטיביות: יכולות לקדם את בריאות מחסום הדם-מוח ולהפחית דלקות עצביות ודלקות מעיים (שמירה על שלמות מחסום המעי). כאשר מחסום המעי פגום (מעי דולף) חומרים מזיקים יכולים להיכנס לזרם הדם, ולגרום לדלקת מערכתית שיכולה להשפיע לרעה על הבריאות המערכתית באופן כללי, ועל בריאות המוח בפרט. על ידי שיפור תפקוד מחסום המעי, SF יכול להפחית דלקת מערכתית ופוטנציאל להגן על המוח מפני דלקת עצבית. הוא מוריד את רמות הציטוקינים הדלקתיים במחזור הדם שיכולים לחצות את ה-BBB ובהמשך לפגוע בתפקוד הקוגניטיבי.
קשר ישיר נוסף למסלולי האיתות בין המעי למוח הוא על ידי ייצור נוירוטרנסמיטרים (סרוטונין, דופמין). ההשפעה של SF על איזון הפעילות המיקרוביאלית של המעי והעדפת חיידקים "טובים" מגבירה את ייצורם של נוירוטרנסמיטורים אלה, אשר ממלאים תפקידים תומכים בקוגניציה, במצב הרוח ובריאות הנפש. לרבות אוטיזם, פרקינסון ודמנציה - נוירוגנזה ופלסטיות סינפטית – התהליך שבו תאי גזע עצביים מייצרים נוירונים חדשים.
SF נמצא מגביר את הנוירוגנזה במודל אלצהיימר על ידי הגברת הביטוי הנוירוני של גורם נוירוטרופי מוחי (BDNF), התומך ביצירת נוירונים.
SF מעלה את איתות Wnt/β-catenin – משפחה של חלבונים הממלאים תפקידים קריטיים ברקמות רבות, כולל התפתחות עוברית והומאוסטזיס של רקמות בוגרות ובתאי גזע עצביים, בכך מקדם את התפשטותם והתמיינותם לנוירונים פונקציונליים.
ל-SF יש גם יכולת יוצאת דופן לשפר את הפלסטיות הנוירונית הקשורה לשיפורים בלמידה ובזיכרון. - תגובת הלם חום (HSR) – תהליך ציטופרוטקטיבי אבולוציוני מורכב המגן על תאים. בתנאי עקה, חלבוני הלם חום (HSPs), נקשרים לחלבונים המקופלים באופן שגוי, ועוזרים לקפל אותם מחדש, למנוע צבירה ולווסת את פירוקם.
ל-SF השפעות נרחבות על חלבוני HSP - מניעת אפופטוזיס – מוות תאי מתוכנת בעקבות עקה חמצונית. כאשר זה קורה יותר מדי בתאי עצב. זה קשור לירידה קוגניטיבית.
SF מגן מפני מוות של תאים עצביים על ידי עיכוב אפופטוזיס, הגברת גורם נוירוטרופי (BDNF), שיכול לשפר את תפקוד העצב והפלסטיות שלו, ולתמוך בנוירוגנזה (ייצור תאי עצב). - אוטופאגיה – התהליכים התאיים האחראים לפירוק והסרה ממוקדים של תאים, חלבונים ואברונים פגומים, כולל מיטוכונדריה פגועה (מיטופגיה).
החוקרים מסבירים שאחת ההשלכות של השטף המטבולי הגבוה (פעילות מיטוכונדרית) במוח היא עלייה בחמצון חלבונים. מצב זה מחמיר על ידי דלקת עצבית, כך שהצטברות וצבירה של חלבונים פגומים ציטוטוקסיים הם סימן היכר של רוב המחלות הנוירודגנרטיביות.
אוטופגיה ממלאת תפקיד חשוב בבקרת איכות המיטוכונדריה, ועלייה ברמת האוטופגיה על ידי SF היא אסטרטגיה נוספת למניעת נזק קוגניטיבי הקשור לגיל והתפתחות מחלות נוירודגנרטיביות. שכן חלק מעבודת האוטופגיה מבוצעת על ידי פרוטאזומים, ו-SF מפעיל פרוטאזומים להסרת חלבונים פגומים באמצעות ויסות Nrf2 של מערכת הפרוטאזומים. - השפעות אפיגנטיות – שינויים תורשתיים בביטוי גנים המתרחשים מבלי לשנות את רצף ה-DNA.
אחת הפעולות האפיגנטיות העיקריות של SF היא עיכוב של אנזימי היסטון (HDACs), שמוביל לביטוי גנים מופחת. נמצא כי עיכוב HDAC המווסת על ידי SF גורם ישירות לעלייה בביטוי של גנים של מטרה מסוג Nrf2, המגנים מפני עקה חמצונית ודלקת. העיכוב של HDACs, מקדם מצב רגוע יותר, ובדרך כלל משפר את התעתוק של גנים המעורבים בהגנה נוגדת חמצון, הגנה עצבית ופלסטיות סינפטית. כמו כן SF יכול לווסת miRNA המקושרים לדלקת עצבית ועקה חמצונית
החוקרים גם מציגים את ההשפעה של SF על הפרעות ספציפיות:
- הפרעות מצב רוח, דיכאון וחרדה.
הפרעות החולקות מנגנונים הכוללים חוסר ויסות חיסוני, עקה חמצונית ותפקוד לקוי של ציר ההיפותלמוס-יותרת המוח-אדרנל (HPA). SF הוכיח השפעות נוגדות דיכאון וחרדה מבטיחות במודלים שונים של בעלי חיים, עם ראיות קליניות מתפתחות התומכות בפוטנציאל שלו בבני אדם, SF מפחית ציטוקינים פרו-דלקתיים (IL-6, TNF-α), מגביר ציטוקינים נוגדי דלקת כמו IL-10, ומשפר את פעילות המיקרוגליה. - אוטיזם.
- סכיזופרניה.
- ירידה קוגניטיבית הקשורה לסוכרת.
- תפקוד קוגניטיבי וליקוי זיכרון.
- אלצהיימר.
- פרקינסון.
- מחלת הנטינגטון.
- פגיעה מוחית טראומטית (TBI) ופגיעה בחוט השדרה (SCI).
- פגיעה מוחית הנגרמת על ידי איסכמיה.
- שבץ.
- הפרעות הקשורות לאלכוהול.
- אפילפסיה ופירכוסים (סעיף 11).
- הפרעות שינה.
משפחת המצליבים לא מתקבלת היטב אצל כולם. זה תלוי בעיקר באופי המיקרוביום.
אצל מי שמתקבל טוב כדאי לקצוץ אותו ולא לבשל אותו בטמפרטורות גבוהות לאורך זמן. אידוי במשך דקה עד שלוש ובטמפרוטורות הנמוכות מ-140 מעלות ישמרו על רמות טובות של סולפוראפן.
לחוששים מירידה ברמות היוד. פשוט להפריד בינו לבין מאכלים מהים או מתוספי יוד.
דרך ידידותית אחרת ואולי גם עם ריכוז גבוה במיוחד של סולפוראפן, שלא נמצאו משפיעים על בלוטת התריס וגם ידידותיים למערכת העיכול אפילו בחולי קרוהן היא צריכת הנבטים של הברוקולי.
לחלק של הפרקטיקה! מה עושים עכשיו ואיך מיישמים את כל הידע הזה.
🧰 ארגז הכלים המעשי, 🗓️ תוכניות פעולה הדרגתיות ליישום הרגלים קריטיים.
🛒 רשימות קניות ממוקדות וטבלאות רכיבים, 👨🍳 מתכונים קלים ומדויקים.
💡 הנחיות יישום (מה זה אומר בפועל). 🔬 הרחבות, נספחים, 🚨 תוספים ודיוקים.
🌟המודולים מסודרים בטבלה לפי נושאים נחקרים 🌟
👈 מוזמנים לפנות אלי באופן פרטי לווטסאפ (0544-606696).👉
🤝 ולהכיר את הקבוצה: "לצאת מעדר הרגיל – הפרקטיקה"
היי לך.. אני משקיע שעות רבות כל יום באיתור ותרגום מאמרים כדי לספק לכולם את המידע העדכני ביותר, לבריאות טובה בדרך הטבע. וכדי שאוכל להמשיך לספק את המידע ולתחזק את האתר. כל תרומה, גדולה או קטנה תהיה לעזר רב. לתרומה נוחה ופשוטה דרך Pay Pal.
כדי להתעדכן ראשונים מוזמנים להזין דוא"ל למטה





כתיבת תגובה