אני אתחיל ואומר שאני פחות נוטה לעסוק בויטמין בי זה או אחר, אולי בי 12 ופולאט הם יוצאי דופן, אבל בגדול אני חושב שאין שום סיבה לחסר שלהם אם התזונה מגוונת ומלבד השניים שהזכרתי אני חושב שהם עובדים טוב יותר ביחד כקומפלקס ולא כתוסף בודד.
תיאמין (ויטמין B1) כשאר ויטמיני בי הוא מסיס במים.
תיאמין מעורב במספר תפקודים בסיסיים של תאים ובפירוק של חומרים מזינים לאנרגיה[1][2]. הוא למעשה נדרש על ידי הגוף שלנו כדי להשתמש נכון בפחמימות בכל התאים ובכל המערכות ולכן מחסור שלו עלול להוביל לפגיעה בייצור אנרגיה ותפקוד לקוי של תאים ואיברים רבים[1][2] אולי במיוחד לתסמונת מטבולית[1][2][3] (בריברי[1], סוכרת הריון[1]), מערכת העצבים ההיקפית[1][2] והמוח[1][2] (תסמונת ורניקה[1], דמנציה/זיכרון[1][2][3][4], כאבים[1], כאב ראש מקבצי[1], שבץ ושיקום[1]), בעיות לבביות (אי ספיקת לב[1][2][3][4], התקף לב[1], תסמונת פוטס[1]), בעיות עיכול, פגיעה בכלי דם קטנים, הפרעות הקשורות להזדקנות, מחלת כליות[1], סרטן, אלח דם[1], הלם זיהומי[1][2] ואפילו מוות.
הגוף לא דורש ממנו הרבה למשל אדם בוגר צריך בין 1-1.4 מ"ג ליום (תלוי מין, הריון) יש אותו כמעט בכל סוגי המזונות החל מדגנים מלאים [כ-500 מק"ג ל-100 גרם], קטניות [כ-600-850 מק"ג ל-100 גרם], אגוזים [קשיו 690 מק"ג ל-100 גרם, פקאן 660 מק"ג ל-100 גרם, ברזיל 616 מק"ג ל-100 גרם], גרעיני דלעת [240 מק"ג ל-100 גרם], חמניות [100 מק"ג ל-100 גרם], שומשום מלא [930 מק"ג ל-100 גרם), צ'יה [635 מק"ג ל-100 גרם].
מדוע להזכיר חסר שלו?
כי מחסור ב-B1 עלול להתפתח במוח ובאיברים חיוניים אחרים כתופעת לוואי של תרופות מסוימות על פי מחקר שפורסם באוקטובר 24 בכתב העת Nature Communications. וזה יכול לקרות למרות רמות B1 תקינות בדם, מה שלעתים קרובות גורם לחוסרים כאלה לא להתגלות לפני שיהיה מאוחר מדי.
כדי להבין מה עומד מאחורי חוסרים נסתרים כאלה, קבוצה של חוקרים ממעבדות EMBL והמרכז הביולוגי CSSB השתמשו בביולוגיה מבנית ובטכניקות ביו-פיזיקליות כדי לחקור כיצד ויטמין B1 נע בגופנו כדי להגיע לרקמות שונות, ואילו גורמים יכולים לעכב את התקדמותו.
במסעו מהמעי לתאי הגוף, ויטמין B1 חייב לעבור דרך מספר ממברנות הפועלות כמחסומים – החל מדופן המעי, לאחר מכן כלי דם, איברים, ולבסוף, ממברנות של תאים בודדים. המחמיר שבהם הוא מחסום הדם-מוח.
כדי לאפשר לוויטמינים וחומרי מזון אחרים להגיע לתאים בכל הגוף, ממברנות אלו מצוידות במולקולות טרנספורטר מיוחדות (חלבוני תובלה) המאפשרות להם לעבור את המחסומים. במקרה של ויטמין B1, העבודה הזו נעשית בעיקר על ידי שני טרנספורטרים: SLC19A2 ו-SLC19A3 (לא חשוב שמות).
החוקרים בחנו את SLC19A3, הטרנספורטר החיוני להעברת B1 על פני דופן המעי ומחסום הדם-מוח. הם יצרו 'סרט מולקולרי' על ידי הרכבת סדרה של צילומים שהושגו ממיקרוסקופ אלקטרוני. בצורה זו הם לכדו את הדינמיקה של תהליך ההובלה והאופן שבו הטרנספורטר מזהה ודוחף את B1 על פני קרום התא. התמונות אפשרו להם לקבוע אילו חלקים של הטרנספורטר SLC19A3 הם הקריטיים ביותר כדי שהוא יפעל כהלכה. אם חלקים אלה לא תקינים, הטרנספורטר לא יעבוד.
החוקרים מציינים שזה מסביר מדוע מוטציות בחלקים קריטיים אלו פוגעות בהובלת B1 למוח ומובילות לתסמינים נוירולוגיים חמורים. מצבים נדירים אלה, שמתחילים להתבטא בתסמינים בינקות, מטופלים במינונים גבוהים של B1 ותרכובות אחרות. למרות זאת, אחד מכל 20 חולים מת וכמעט שליש עדיין סובל מתסמינים. לכן.. כדי לחקור זאת, הם יצרו גרסה של הטרנספורטר SLC19A3 הנושא מוטציה הגורמת למחלת מוח קשה ונדירה בשם Biotin-thiamine-responsive basal ganglia disease (BTBGD). מה שאפשר להם לראות בדיוק כיצד המוטציה משפיעה על המבנה המולקולרי של הטרנספורטר והופכת אותו ללא קולט ויטמין-B1.
החוקרים מציינים שתסמינים חמורים של מחסור ב-B1 יכולים להיגרם לא רק על ידי מוטציות נדירות, אלא גם על ידי תרופות מסוימות. מספר תרופות נפוצות, כולל כמה תרופות נוגדות דיכאון, אנטיביוטיקה ותרופות אונקולוגיות, פוגעות בטרנספורטר (SLC19A3).
כלומר יכול להווצר מצב שבו תרופות אלה לא מאפשרות לויטמין B1 להגיע לתאים במוח ובכך לסכן את תפקודי המוח בזמן שרמות ה-B1 בדם תקינות, מה שהופך את הסיטואציה לבלתי ניתנת לזיהוי בבדיקות דם סטנדרטיות. כלומר מדובר במחסור נסתר שיכול להוביל בשקט לחוסר תפקוד חמור של המוח, שעלול להיות גם קטלני.
החוקרים מוסיפים שמלבד תרופות אלה "ייתכן שיש עוד הרבה יותר שאיננו מודעים אליהם, זיהוים אינו פשוט, ולכן המחקר הנוכחי נועד להקל (על זהוים). חשפנו את הבסיס המולקולרי לאופן שבו תרופות חוסמות את הטרנספורטר SLC19A3 וכרגע אנחנו משתמשים בידע הזה כדי לסנן את כל התרופות שאושרו על ידי ה-FDA וה-EMA לאיתור השפעות דומות".
החוקרים גם זיהו את המאפיינים המבניים שגורמים לתרופה לפגוע בהובלת B1. לשם כך, הם השתמשו במיקרוסקופ אלקטרוני ובטכניקות ביו-פיזיקליות כדי לנתח כיצד חוסמים ידועים מתקשרים עם SLC19A3. באמצעות הידע הזה, הם זיהו שבע תרופות חדשות שחוסמות את הטרנספורטר B1 במבחנה וצפויות לעשות זאת גם בגוף האדם. אלה כוללים מספר תרופות נוגדות דיכאון, הידרוקסיכלורוקין ושלוש תרופות לסרטן.
החוקרים חושבים שתוצאות אלו יעזרו לנטר טוב יותר את בריאותם של חולים הנוטלים את התרופות הללו, הם גם מאמינים שהעבודה הזו יכולה ליצור בסיס לחקר האופן שבו תרופות מתקשרות עם מעבירים דומים בגוף האדם. בטווח הארוך, זה עשוי גם להנחות את התכנון של תרופות עתידיות שיוכלו להשתמש באותם מובילים כדי להגיע לאיברי מטרה בצורה יעילה יותר
https://www.embl.org/news/science-technology/vitamin-b1s-journey-in-your-body-and-why-it-matters/.
לסיכום: אנחנו לא יודעים עדין שום דבר על מה קורה בתוך הגוף שלנו כאשר אנחנו צורכים תרופות. במחקר הנוכחי מדובר על חסר תיאמין תוך תאי ולא חסר במחזור הדם. מצב שראינו שקשה מאוד לאבחן אותו והוא מסכן חיים.
כמו כן המחקר הזה מציג שאלות לגבי אילו תרופות אחרות יכולות לייצר חסרים תאיים של ויטמינים ומינרלים אחרים, שהרי לכולם טרנספוטרים לתוך התא.
***תוספת יולי 25: תיאמין – רגולטור חיוני לבריאות
סקירה מקיפה שפורסמה בביולי 25 בכתב העת Nutrients מדגישה את תפקידיו המהותיים של ויטמין B1 כרגולטור חיוני בשמירה על בריאות תאית ומטבוליזם אנרגטי. המחקר מציין כי תיאמין חיוני לתפקוד תקין של אנזימים המעורבים במטבוליזם הגלוקוז, תהליך קריטי לאספקת אנרגיה לתאים, אשר בתורו הכרחי למנגנוני תיקון DNA. בנוסף, הוא מהווה תנאי הכרחי לתפקוד אנזימי מפתח בסינתזת חומצות גרעין. לתיאמין גם תכונות נוגדות חמצון המסייעות בהפחתת עקה חמצונית בתאים, ובכך תומכות בעקיפין בשמירה על שלמות ה-DNA. הסקירה מדגישה כי הבטחת צריכת תיאמין נאותה באמצעות תזונה או תוספים יכולה לתמוך בבריאות התאית הכללית ולסייע בתהליכי תיקון DNA.
מנגנוני פעולה מולקולריים
- קופקטור קריטי ומרכזי לאנזימים רבים בגוף. הוא משחק תפקיד חיוני בנתיבי מטבוליזם שונים, כולל אלה הקשורים לגלוקוז, חומצות שומן וחומצות אמינו. תיאמין חיוני במיוחד ב"נתיב הפנטוז פוספט" (PPP) – מסלול מטבולי חשוב בתא. בנתיב זה, תיאמין פועל כקו-אנזים לאנזים טרנסקטולאז (TKT). פעילות זו מכריעה בייצור חומרים חיוניים כמו NADPH שחשוב במיוחד להגנה נוגדת חמצון בתאים כחלק ממערכות גלוטתיון ותיורדוקסין וריבוז שמהווה מרכיב מפתח לסינתזת DNA ו-RNA.
- תיאמין עשוי לווסת את פעילות הגנים של אנזימים הדורשים אותו לפעילותם. הוא אף נמצא משפיע על חלבון ה-p53, המכונה "שומר הגנום" שמפחית מוות תאי מתוכנת. חסר של תיאמין משבש מסלולים אלה, ומוביל לעלייה של מיני חמצן תגובתיים (ROS) ובמינים חנקניים תגובתיים (RNS), מה שמגביר עקה חמצונית בתאים ופוגע בתפקוד המיטוכונדריאלי. הדבר עלול להפעיל תגובות דלקתיות דרך מסלולים כמו HIF-1α ו-NF-κB."
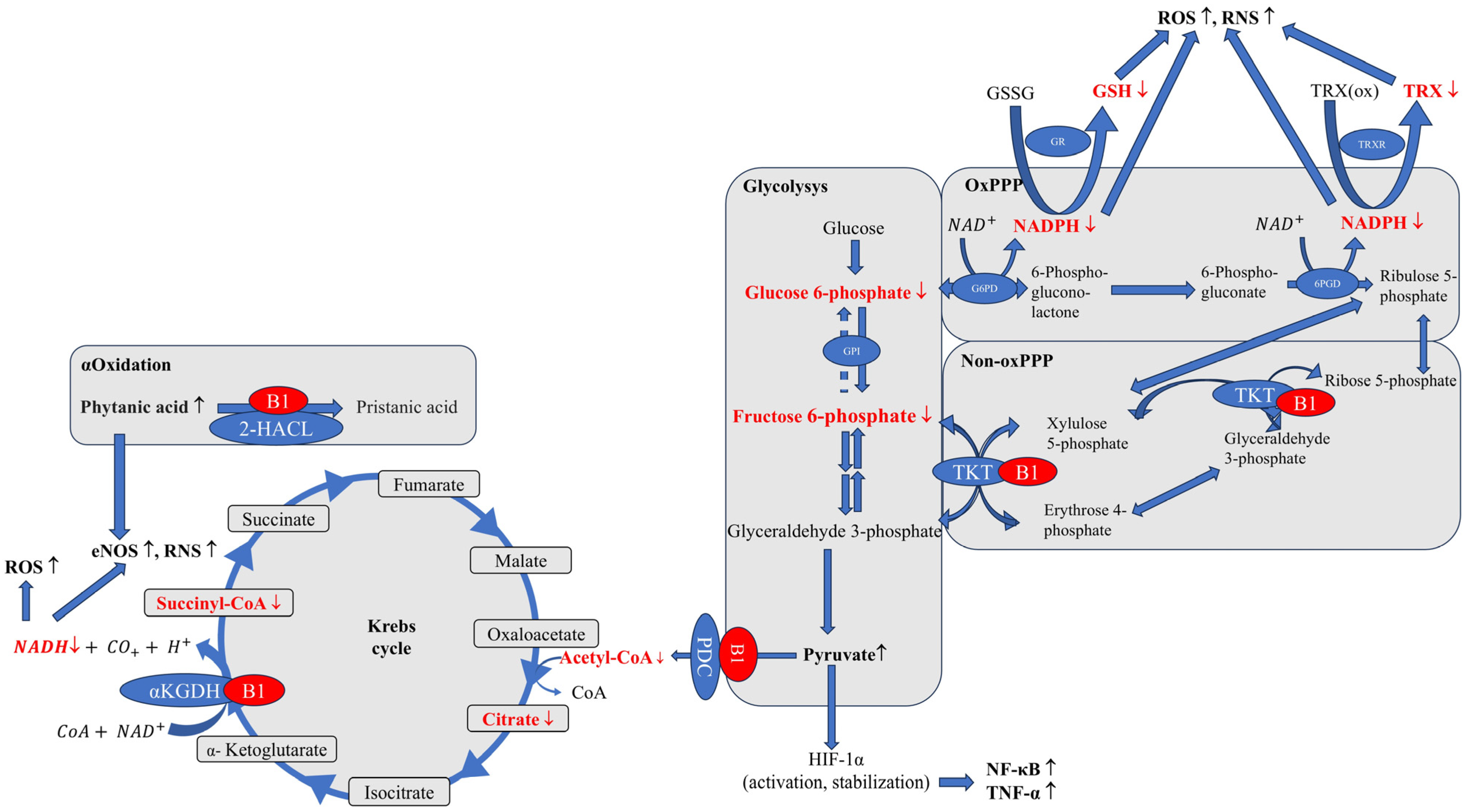
החוקרים מציינים בסקירה שחסר תיאמין אינו נדיר כפי שחושבים והוא עלול להתרחש במגוון אוכלוסיות ומצבים מעבר לתזונה לקויה (תת-תזונה, דיאטות מגבילות) ותרופות (נוגדות דיכאון, אנטיביוטיקה ותרופות אונקולוגיות) שהוזכרו למעלה. בין הגורמים הנוספים המצוינים: כימיקלים סביבתיים, תוספי מזון מסוימים, אלכוהוליזם, הפרעות בעיכול (הקאות חוזרות), סיבוכים כירורגיים, שימוש כרוני במשתנים (דיורטיקה) וכן במצבים כמו איידס והיפרמזיס גרבידרום בהריון. המחקר מצביע על תסמינים מוקדמים לא ספציפיים לחסר, הכוללים עייפות מתמשכת, שינויים במצב הרוח, עצבנות יתר, "ערפל מוחי", פגיעה עדינה בזיכרון, אובדן תיאבון והפרעות שינה.
השלכות בריאותיות וטיפוליות נוספות:
מעבר להפרעות הבריאותיות החשובות שצוינו למעלה הסקירה מקשרת באופן מובהק בין צריכת תיאמין לבין שכיחות יתר לחץ דם והתקפי לב, סוכרת, ובעיות נפשיות עם דגש על דיכאון.
היא גם מדווחת על יתרונות של תוסף תיאמין במינונים גבוהים (300 מ"ג ליום), שיכול לשפר לחץ דם בחולי היפרגליקמיה, לשפר סבילות לגלוקוז ולעכב התפתחות סוכרת סוג 2 בשלבים מוקדמים.
היי לך.. אני משקיע שעות רבות כל יום באיתור ותרגום מאמרים כדי לספק לכולם את המידע העדכני ביותר, לבריאות טובה בדרך הטבע. וכדי שאוכל להמשיך לספק את המידע ולתחזק את האתר. כל תרומה, גדולה או קטנה תהיה לעזר רב. לתרומה נוחה ופשוטה דרך Pay Pal.
כדי להתעדכן ראשונים מוזמנים להזין דוא"ל למטה





כתיבת תגובה