הפרעת קצב לב הוא מצב בו מדורי הלב העליונים (פרוזדורים) פועמים במהירות ובצורה בלתי מבוקרת (פרפור). פעימות מהירות ובלתי סדירות אלה של הפרוזדורים משפיעות על זרימת הדם בלב, ויוצרות דופק לא סדיר ולעתים אף תחושה של דפיקות בחזה. מדובר בהפרעה די שכיחה, שהסיכון לה עולה עם הגיל, והיא גם קשורה לסיכון מוגבר לשבץ מוחי, אי ספיקת לב ותמותה בין היתר בשל התנאים להיווצרות קרישי דם.
שומן הוא חלק בלתי נפרד מפעילות תקינה של הגוף, מטבולית, הורמונלית ועצבית. סוגי השומן מחולקים ל-3 קבוצות: רווי, חד בלתי רווי ורב בלתי רווי.
בעיות יכולות לצוץ כאשר מגזימים ביחס חומצות השומן אל מול יתר אבות המזון (חלבונים ופחמימות) למשל בתזונה מבוססת חיות כמו קיטו ופליאו; כאשר היחס בין קבוצות השומן נוטה יותר לכיוון הרווי (פחות חד ובלתי רוויות) למשל בתזונה המערבית וכאשר חומצות השומן מתחמצנות על ידי רדיקלים חופשיים מהאוויר, מים ומזון.
אומגה 3 היא חומצת שומן חד בלתי רוויות והן אולי החסרות ביותר בכמותן בתזונה המערבית הטיפוסית שרבים צורכים אותה ברחבי העולם ובישראל.
אומגה 3 היא גם חומצת השומן הנחקרת ביותר וחוסר שלה נמצא קשור למחלות רבות (מטבוליות, כלי דם ולב, מוח, עור, דלקות ועוד).
יש 5 צורות לאומגה 3 (ALA, SDA, ETA, EPA, DPA, DHA) לכולן משמעות בריאות ורק ה-ALA נחשבת בהגדרה לחיונית עבור בני האדם. ממנה הגוף יודע לייצר את כל ה-4 הנוספות. צרכני דגים יקבלו רק EPA ו-DHA, שהן הנחקרות ביותר בבני אדם ולכן יש גם את התחושה שהן העיקריות.
מחקר שפורסם ביולי 24 בכתב העת International Journal of Molecular Sciences, צוות מחקר מיפן יצא לבחון את הקשר בין חומצות שומן רוויות, אומגה 3 והפרעות בקצב הלב. הם חקרו את התפקיד של EPA בהשראת שינויים חשמליים ארוכי טווח בתאי הלב (קרדיומיוציטים) של עכברים ובתרבית תוך שימוש במגוון טכניקות ביואנליטיות.
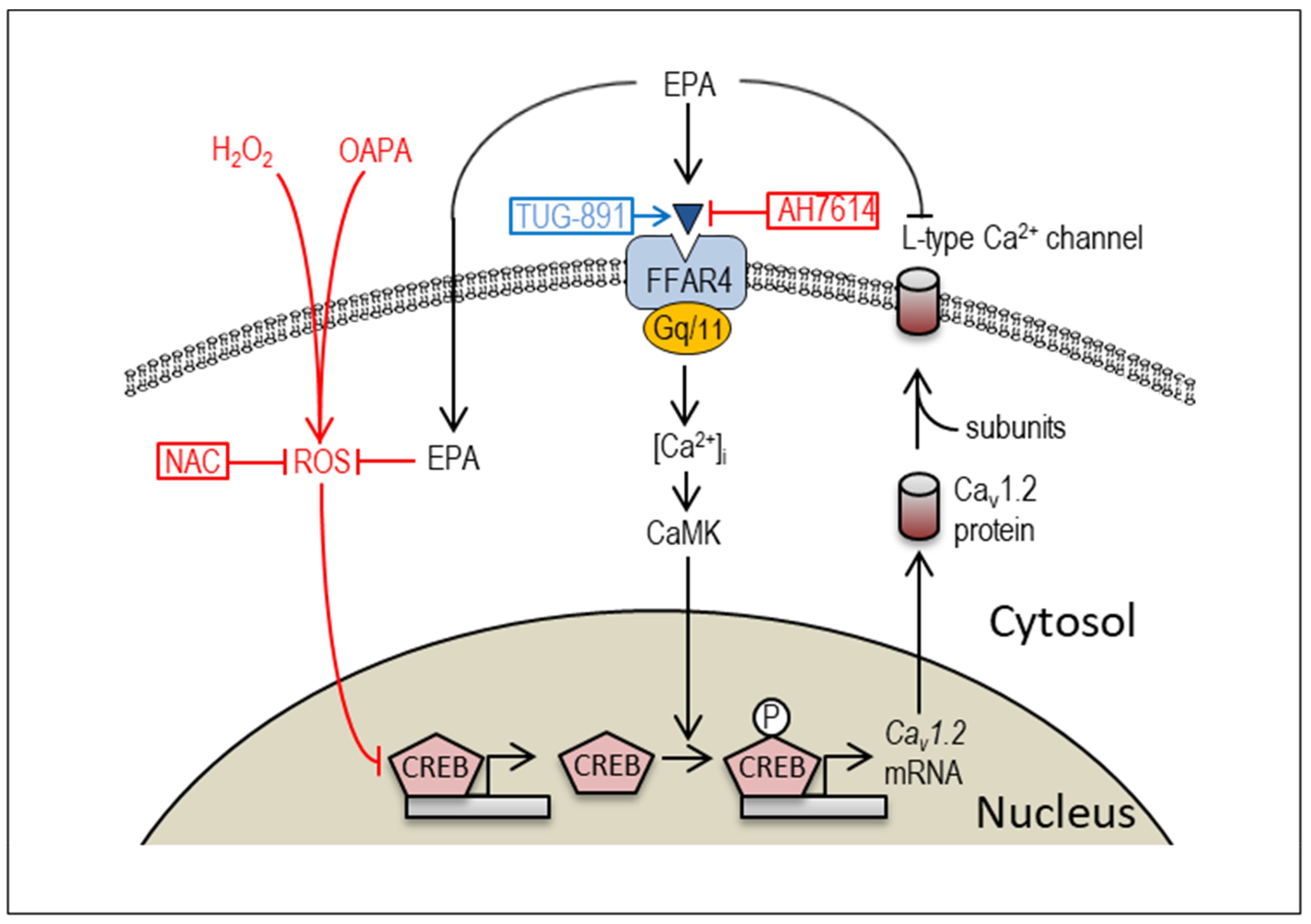
ההתמקדות העיקרית של עבודה זו הייתה על האופן שבו תערובת חומצה אולאית וחומצה פלמיטית (OAPA), 2 חומצות שומן, שנמצאו משפיעות על הומאוסטזיס סידן בקרדיומיוציטים על ידי השפעה על תעלות יוני Ca2+. ובמקביל לענות על השאלה האם EPA יכול להציל את השינויים הללו ולהחזיר את התפקוד התקין.
ראשית החוקרים מצאו כי OAPA הפחית באופן ניכר את רמות ה-mRNA של תעלות Ca2+ מסוג Cav1.2 הקשורות לתפקוד קצב הלב (תרופות אנטי אריתמיות עובדות במנגנון זה). OAPA נמצאה גם מורידה את קצב הפעימה הספונטנית של קרדיומיוציטים בניסויי מעבדה.
החוקרים מציינים ששינויים אלו נמנעו כאשר אפילו כמות קטנה של EPA יושמה יחד עם OAPA, והצילה את רמות הביטוי של ה-mRNA והפעילות של Cav1.2.
כדי לקבל תובנות מפורטות יותר לגבי ההשפעות של OAPA ו-EPA, הצוות התמקד בגורם שעתוק המכונה (CREB), שהזרחון שלו משמש כאינדקס של שעתוק Cav1.2. הם ראו ש-OAPA הפחית את ה-mRNA של CREB באופן שתואם לחלוטין את השינויים ב-Cav1.2 mRNA, וה-EPA הצליח למנוע את השינויים הללו.
בהמשך הניסויים שלהם הם גם בחנו את הקולטן של חומצות השומן בתאים הנקרא free fatty acid receptor 4 (FFAR4). באופן מעניין, החוקרים הבחינו כי אגוניסט ל-FFAR4, המחקה את ההשפעות של EPA, הציל את השינויים שנגרמו על ידי OAPA, בעוד שאנטגוניסט ל-FFAR4 חסם לחלוטין את ההשפעות של EPA. יחד, ממצאים אלו חושפים כי EPA מעורב במסלול רגולטורי המתווך על ידי FFAR4 המשפיע על ויסות תעלות Ca2+ מסוג L בקרדיומיוציטים.
סט אחרון של ניסויים גילה ש-OAPA אחראי ללחץ חמצוני באמצעות הצטברות של מיני חמצן תגובתיים (ROS). ושוב, EPA יכול להציל הצטברות ROS שנגרמה על ידי OAPA.
"תוצאות המחקר שלנו מצביעות על כך של-EPA יש השפעה מגנה על קרדיומיוציטים על ידי נורמליזציה של חריגות הנגרמות על ידי צריכת כמויות מוגזמות של חומצות שומן רוויות, המופיעות בתזונה עתירת שומן"
הצוות מסכם ומקווה שממצאים אלו יסללו את הדרך לבחירות תזונתיות חכמות יותר ולהנחיות בריאות חדשות, ובתקווה לעתיד בריא יותר.
www.eurekalert.org/news-releases/1054702
מחקרים נוספים המראים קשר בין אומגה 3 למנעה וויסות הפרעות קצב לב [1][2][3][4][5][6][7][8][9][10][11][12].
למחקר המרכז על הפרכות קצב מניעה וטיפול. היכנסו.
היי לך.. אני משקיע שעות רבות כל יום באיתור ותרגום מאמרים כדי לספק לכולם את המידע העדכני ביותר, לבריאות טובה בדרך הטבע. וכדי שאוכל להמשיך לספק את המידע ולתחזק את האתר. כל תרומה, גדולה או קטנה תהיה לעזר רב. לתרומה נוחה ופשוטה דרך Pay Pal.
כדי להתעדכן ראשונים מוזמנים להזין דוא"ל למטה





כתיבת תגובה